ペプチド合成
ペプチドは、2つ以上のアミノ酸がアミド結合で結合しており、通常2~70アミノ酸の長さのアミノ酸の鎖を形成しています。ペプチドは生物学的活性のために折りたたまれる必要がないという点でタンパク質と区別されます。ペプチドは血管緊張、LHRH、エンケファリンなどのペプチドホルモンとして、また植物や動物の毒素として内因的に発生します。ペプチドは創薬のリード化合物として、またそれ自体が医薬品として非常に興味深いものです。また、ワクチン、生体材料、組織学的プローブにも応用されており、抗体を生成するための抗原としても大量に使用されています。
ペプチドは、溶液中または固相上で化学的に合成されます。一連のプロセスでは、N末端保護アミノ酸と、遊離アミノ基および保護されたカルボン酸を有するアミノ酸との間に、方向性を持ち選択的にアミド結合が形成されます。固相合成では、カルボキシル保護基がポリマー支持体に結合しています。結合形成に続いて、ジペプチドのアミノ保護基を外し、次のN末端保護アミノ酸が結合されます。
注目のカテゴリー

Figure 2Side-chain protecting groups for Boc solid-phase peptide synthesis (SPPS)
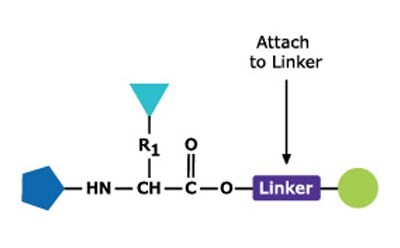
固相ペプチド合成(SPPS)は、その効率、単純さ、速度、並列化の容易さから、ペプチド合成で最も頻繁に使用される方法です。SPPSは、不溶性ポリマー支持体に結合したアミノ酸またはペプチドに、アミノ酸残基や側鎖保護アミノ酸残基を連続的に付加していくことで進行します(図1)。
酸に不安定なBoc基(Boc SPPS)または塩基に不安定なFmoc基(Fmoc SPPS)のいずれかが、N-α保護に使用されます。この保護基を除去した後、カップリング試薬または事前に活性化された保護アミノ酸誘導体のいずれかを使用して、次の保護アミノ酸をつなげ伸長反応を進めます。C末端アミノ酸はリンカーを介してレジンに固定されており、リンカーの性質により、鎖伸長後にペプチドをレジンから切り出すために必要な条件が決まります。側鎖保護基は、レジンからのペプチドの切り出しと同時に切断されるようにしばしば選択されます(図2および図3)。

Figure 3.Side-chain protecting groups for Fmoc solid-phase peptide synthesis (SPPS)
ほとんどのペプチドはFmoc法で調製され、これは、特殊な装置の中で毒性が高く腐食性の液体無水HFを使用する必要があるBoc法とは対照的に、最終的な切り出しと脱保護がトリフルオロ酢酸での処理によって行われます。
50残基程度のアミノ酸からなるペプチド合成例は多くありますが、中には100残基以上のアミノ酸からなるタンパク質の合成も報告されています。溶液中で完全に脱保護されたペプチドを化学ライゲーションすることで、より長いタンパク質を作ることができます。この方法を使用すると、細菌で発現するのが難しい天然ペプチドの合成、非天然やD-アミノ酸の導入、そして、環状、分岐、標識、および翻訳後修飾ペプチドを生成することが可能です。
通常、BocまたはZ-アミノ保護を利用する液相ペプチド合成は、工業的な目的でペプチドを大量に合成する既存のプロセスを除き、固相ペプチド合成に取って代わられています。
関連資料
- Novabiochem® offers a wide range of linkers and derivatized resins for Fmoc solid-phase peptide synthesis with specialized protocols.
- Chromogenic and fluorogenic derivatives are invaluable tools for biochemistry, having numerous applications in enzymology, protein chemistry, immunology and histochemistry.
- Aspartimide formation 1,2 is caused by repeated exposure of aspartic acid-containing sequences to bases like piperidine and can result ultimately in the generation of 9 different by-products.
- Novabiochem® offers polymer supports for solid phase peptide synthesis, suitable for various peptide lengths and sequences.
- Long peptide purification removes impurities effectively, crucial for research and pharmaceutical applications.
- すべて表示 (13)
関連プロトコル
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Anhydrous HF is the preferred reagent for peptide cleavage from Boc-based resins, versatile and effective for various peptide synthesis.
- Fmoc resin cleavage and deprotection are crucial steps for peptide synthesis, yielding the desired peptide after resin detachment.
- すべて表示 (7)
技術資料・プロトコルの検索
お問い合わせ
ご不明な点がございましたら、お問い合わせページをご覧いただくか
、テクニカルサービスまでお問い合わせください。
メール:jpts@merckgroup.com
電話:03-6756-8245
サポート
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- 計算ツール・アプリ
ウェブツールボックス-分析化学、ライフサイエンス、化学合成および材料科学のためのサイエンスリサーチツールとリソース
- Customer Support Request
お問い合わせページでは、製品のお問い合わせや、注文や納期、お取引やアカウント、ウェブサイトに関するお問い合わせをお申込みいただけます。
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?



