はじめに
ボロン酸を用いた鈴木-宮浦クロスカップリング反応は高分子科学、ファインケミカル、製薬産業の分野において、有機化学の手法として最も重要で非常に有用性の高い反応の一つです。しかし、多くのボロン酸は非常に不安定で分解しやすいことから、カップリング反応の効率が悪く、長期保存が困難です。そのため、温和な条件下での鈴木-宮浦クロスカップリング反応の反復利用についてはこれまで開発がなされませんでした。最近、イリノイ大学アーバナ・シャンペーン校のMartin Burke教授はN-メチルイミノ二酢酸(MIDA:N-methyliminodiacetic acid)配位子とホウ素中心が三価の錯体形成を経てsp2からsp3へと再混成することによりボロン酸とパラジウム種とのトランスメタル化を弱める方法を開発しました。これは温和な条件下での反復する鈴木-宮浦反応の利用を可能にします。
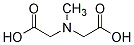
MIDA(M51008)
MIDAで保護されたボロン酸エステルは取り扱いが容易で、空気中で安定かつクロマトグラフィーに適用できます。また、標準的なクロスカップリングの無水条件下、80℃での温度でも不活性です。それにも関わらず、室温下、1M NaOH水溶液やあるいはNaHCO3水溶液などの温和な塩基性水溶液条件で容易に脱保護されます。
参考文献: Gillis, E. P.; Burke, M. D. J. Am. Chem. Soc.2007, 129, 6716.
Sigma-Aldrich®のボロン酸MIDAエステル製品一覧はこちら。
主な利用例
保護基としてのMIDAと反復クロスカップリング
保護基としてのMIDAの効果を実証するために、BurkeらはBuchwaldの鈴木-宮浦反応の無水条件下、ボロン酸MIDAエステル(698229)と4-ブチルフェニルボロン酸の1:1混合物と4-n-ブロモベンズアルデヒドとを反応させました(Scheme 1)。その結果、生成物の混合比は24:1で無保護のボロン酸との反応が優先しました。一方、無保護のボロン酸(393622)あるいはN-メチルジエタノールアミン付加体のいずれかと4-n-ブチルフェニルボロン酸の混合物で実施された反応において選択性は全く見られませんでした。
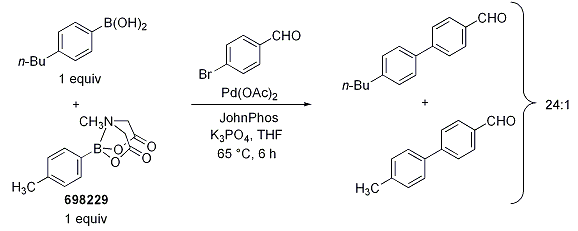
Scheme 1.
Burkeの手法を利用したクロスカップリングの有用性はratanhineの全合成により示されました(Scheme 2)。trans-1-プロペン-1-イルボロン酸とベンゾフラニルボロン酸MIDAエステル1とがカップリングした後に脱保護し、昇温してかさ高い臭化アリールMIDAボロン酸2とクロスカップリングします。こうして得られた中間体を脱保護した後に、臭化ビニル3と反応させることでジMOMエーテルが得られ、2つのMOM基の除去によりratanhineが得られます。単一で温和な反応だけを利用するこのタイプの合成手法は、容易に精製される非常に堅牢なビルディングブロックの構築を可能にします。さらに、反応経路が短くモジュール方式であるため、この反復クロスカップリング法を利用すれば、さまざまな置換基で修飾した一連のビルディングブロック類の合成が可能です。
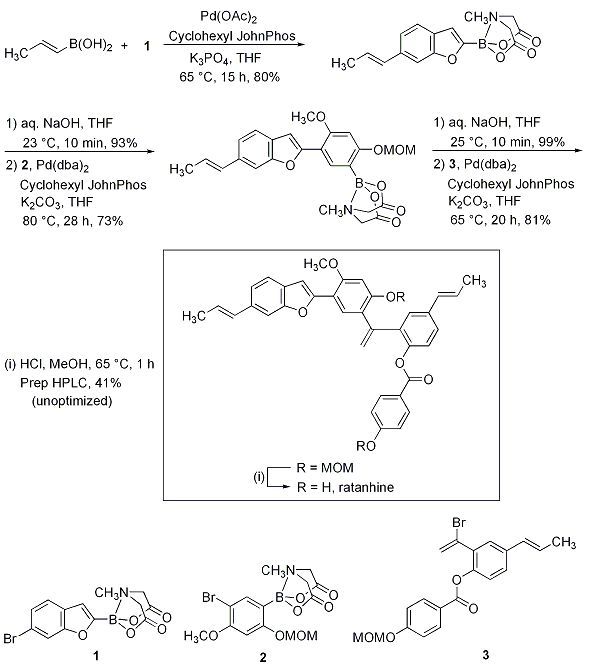
Scheme 2.
ポリエンのMIDA ボロン酸エステル
一般に、ポリエニルボロン酸は非常に不安定で、合成には利用されてきませんでした。Burkeらはボロン酸MIDAエステルの反復クロスカップリングにおける安定性と有用性を示す実例として、アルケニルボロン酸MIDAエステル(703478)を利用し、一連のポリエニルビルディングブロックを合成しています。このボロン酸MIDAエステル末端はHeck反応、Stille反応、鈴木カップリングに対して不活性で、対応するブタジエニルボロン酸MIDAエステルを与えます(Scheme 3)。
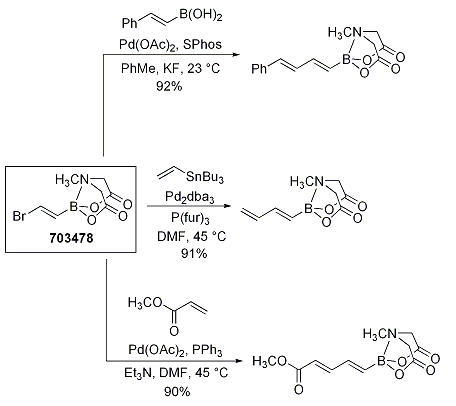
Scheme 3.
このアルケニルボロン酸MIDA エステル(703478)は all-trans-retinal カロテノイドの合成にも利用されています。ポリエニルボロン酸MIDAエステルの合成における現実的な有用性は、中間体4のB-脱保護で円滑にボロン酸を生成し、続いてβ-ブロモエナールとカップリングして all-trans-retinal を与えることから示されています(Scheme 4)。
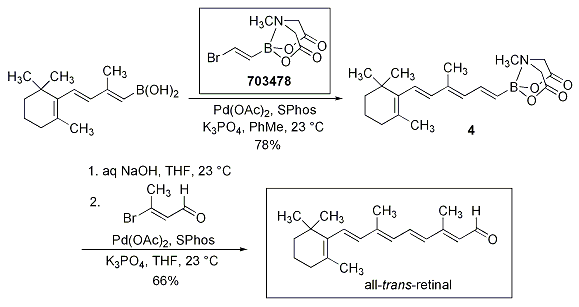
Scheme 4.
さらに重要な点は、宮浦ホウ素化反応、薗頭カップリング、根岸カップリングにより、ビスメタル化された化合物が得られる点です(Scheme 5)。化合物5と6は、ポリエン天然化合物の合成に利用され、β-パリナリン酸の合成(Scheme 6)や安定なポリエンビルディングブロック7を経由してアンホテリシンBのポリエン鎖(Scheme 7)の合成がなされています。
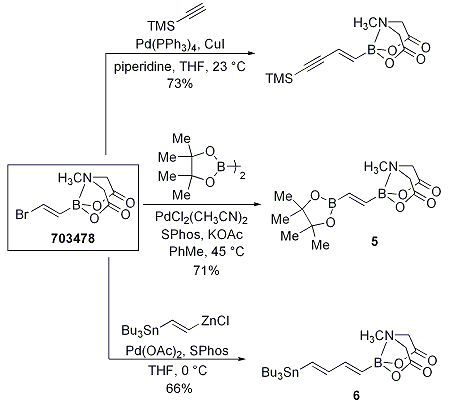
Scheme 5.
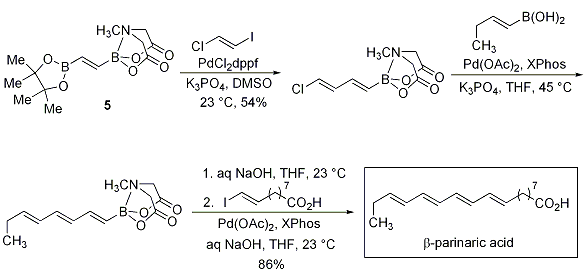
Scheme 6.
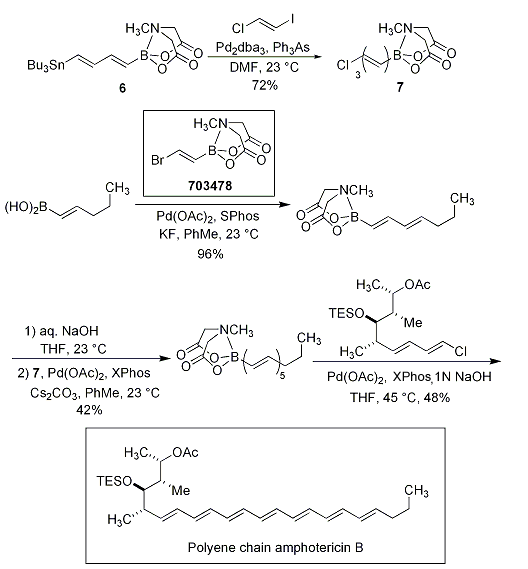
Scheme 7.
ボロン酸MIDAエステルを利用する複雑なボロン酸の合成
ボロン酸MIDAエステルのもう一つの特長として、ボロン酸MIDAエステルには一般的な合成試薬を幅広く利用できるため、官能基化したMIDAボロン酸エステルをさらに修飾して構造的に複雑なボロン酸誘導体を得られることが挙げられます。一般的な酸化剤やその他の反応試剤を用いて、4-(ヒドロキシメチル)フェニルボロン酸MIDAエステル(698105)の変換反応により、合成に有用な一連のボロン酸MIDAエステル類が得られることがBurkeらにより最近報告されています(Scheme 8)。ボロン酸MIDAエステルは、トリフルオロメタンスルホン酸やJones酸化剤のような強力な試薬にも十分安定でした。いくつかのケースでは逆の変換反応も容易に進行し、元の4-(ヒドロキシメチル)フェニルボロン酸MIDAエステルが得られます。
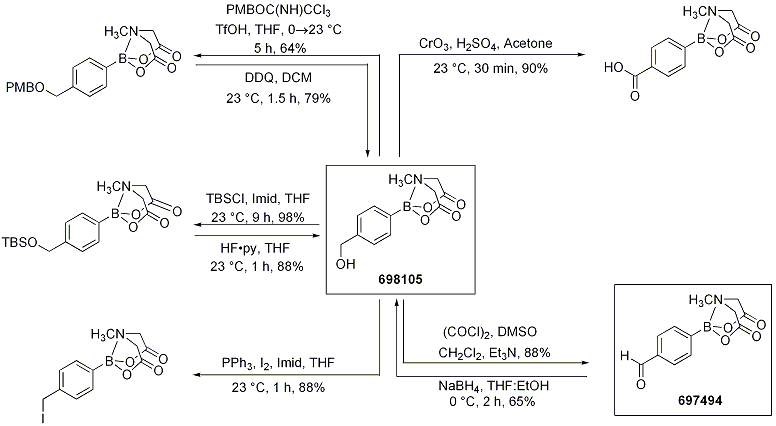
Scheme 8.
4-ホルミルフェニルボロン酸MIDAエステル(697494)はさらにさまざまなC-C結合形成反応に利用できます。下図に示す通り、還元的アミノ化、Evansアルドール反応、Horner-Wadsworth-Emmons反応や高井オレフィン化反応にも適用できます(Scheme 9)。
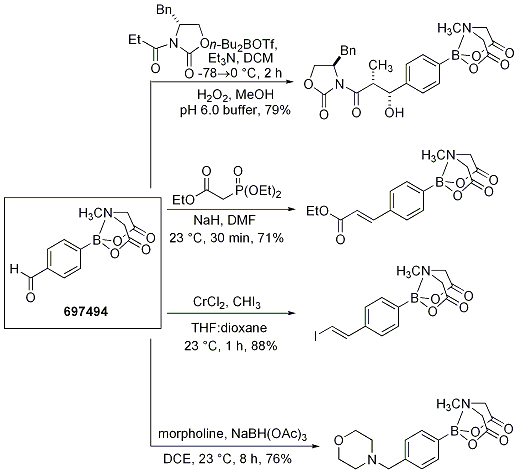
Scheme 9.
ボロン酸MIDAエステルの非常に優れた適用性は、アクロレインボロン酸MIDAエステルを出発物質とする(+)-crocacin Cの全合成により示されました(Scheme 10)。このボロン酸MIDAエステルはPatersonアルドール反応とジアステレオ選択的還元反応によりジオールボロン酸MIDAエステルを与え、シリカゲルクロマトグラフィーにより精製されました。精製されたボロン酸MIDAエステルはMeerwein’s saltによる完全メチル化、CANによる脱保護、Dess-Martinペルヨージナン酸化、高井オレフィン化反応を経て安定な結晶性の複雑なボロン酸MIDAエステル8を与えます。8とビルディングブロック9のStilleカップリング、さらにin situでのボロン酸の遊離、ブロモベンゼンのクロスカップリングを経て(+)-crocacin Cが得られます。
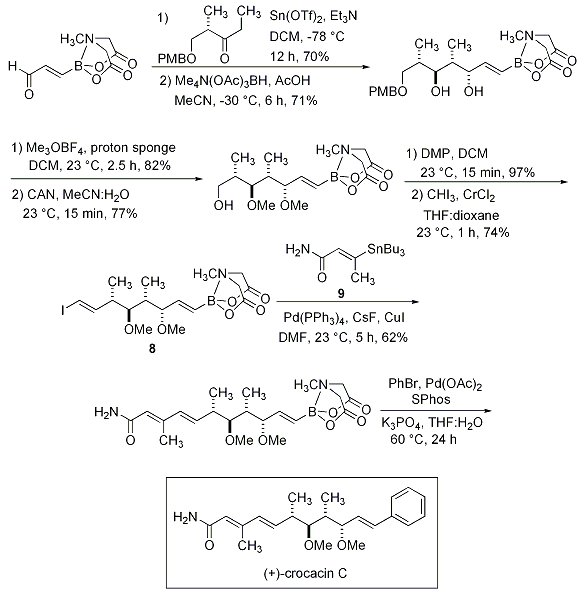
Scheme 10.
シラン化合物を利用するtrans-2-ブロモビニルボロン酸MIDAエステルとビニルボロン酸MIDAエステルの合成
ボロン酸の中には不安定なものがあるため、Burkeらは、不安定なビルディングブロックを合成する非常に実用的な方法を開発しました。例えば、trans-(2-ブロモビニル)ボロン酸MIDAエステル(703478)は、アセチレンのブロモホウ素化と塩基存在下のMIDAとの反応により合成されていましたが、現在では、1-ブロモ-2-トリメチルシリルエチレンのBBr3によるトランスメタル化、続いてMIDA2-Na+2でトラップする簡便な方法が開発されています(Scheme 11-(1))。この方法により非常に有用なビニルボロン酸MIDAエステルも同様に合成されました(Scheme 11-(2) )。これに対応するMIDA無保護のビニルボロン酸は非常に不安定です。
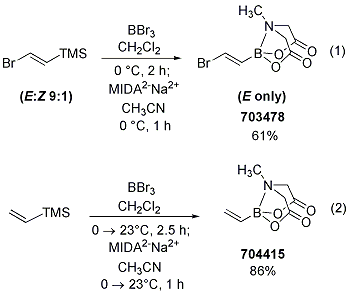
Scheme 11.
ビニルボロン酸MIDAエステルの有用性
ビニルボロン酸MIDAエステルは、シクロプロパン化とエポキシ化によりそれぞれ対応するシクロプロパンとオキシランを与えるため、有用です。いずれの場合(Scheme 12)も空気中やクロマトグラフィーでも安定な固体が得られており、無置換オキシラニルボランの最初の合成例として知られています(オキシラニルボランのX-線分析により確認)。
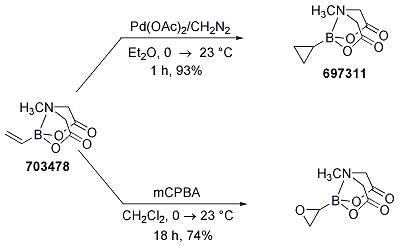
Scheme 12.
ビニルボロン酸MIDAエステルはHeck反応や酸化的Heck反応だけでなくオレフィンメタセシスおいてもクロスカップリング生成物を与えることが見出されました(Scheme 13)。さまざまなオレフィンとビニルボロン酸MIDAエステルのクロスメタセシスは、置換基を持つビニルボランの高立体選択的な構築に有用です。この方法は二置換オレフィンでも利用でき(表 1)、高収率(81~98%)かつジアステレオ選択的(>20:1)です。アルケニルボロン酸エステルは、安定性、ジアステレオ選択性、二置換アルケニルボラン生成物の精製の容易さなどにおいてしばしば制限があったため、この方法は重要な進歩です。
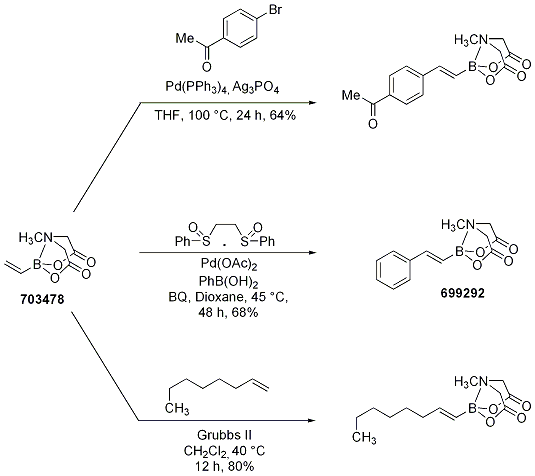
Scheme 13.
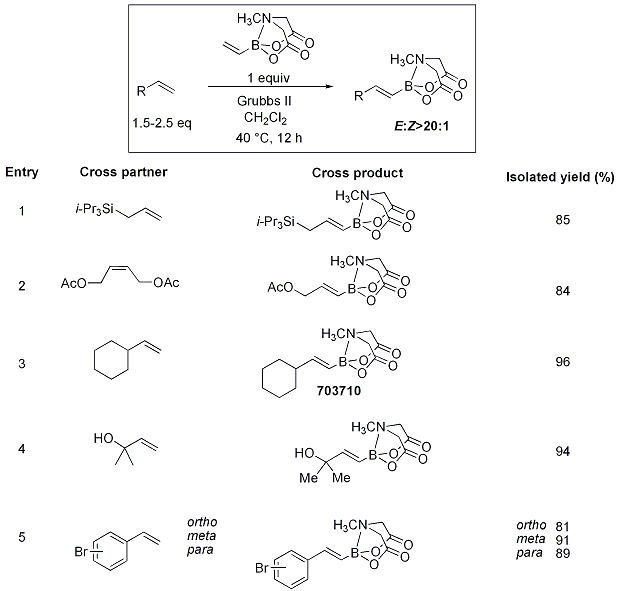
表1.ビニルボロン酸MIDAエステルとのクロスメタセシス反応
ボロン酸MIDAエステルから不安定なボロン酸への緩やかな脱保護
無水条件でのクロスカップリング反応における反応性を弱める性質だけでなく、ボロン酸MIDAエステルには、塩基性水溶液中、in situでボロン酸をゆっくりとリリースする性質があります。この性質を利用して、極めて不安定なボロン酸をMIDAで保護化することでクロスカップリングに用いることが可能になっています。より不安定なボロン酸を緩やかにリリースするにはK3PO4を用います。NaOH水溶液による対応するボロン酸への加水分解が早いのに対し、K3PO4水溶液を用いると比較的不安定なボロン酸がゆっくりとリリースされ、有機金属前駆体の分解を防ぎ、鈴木反応の総収率を改善します。
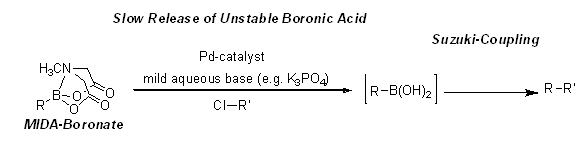
図1.不安定なボロン酸への緩やかな脱保護
- 空気に安定
- 無水条件のクロスカップリングに安定
- 一般的な反応試剤や反応性の高い反応試剤を利用可能
- 種々の有機溶媒に溶解
- シンプルな構造
- シリカゲルを利用可能
- 緩やかなMIDA脱保護によるクロスカップリング反応の達成
Burkeらは、調製してすぐのボロン酸と対応するボロン酸MIDAエステルを比較することにより、実験室レベルでの安定性とクロスカップリングの反応性における緩やかなボロン酸のリリースの効果を検証しています。その研究によれば、多くのボロン酸は、プロト脱ホウ素化(protodeboronation)、酸化、重合その他のさまざまな過程で著しく分解しました(実験室内、空気中で15日間-表 2)。一方、対応するボロン酸MIDAエステルは非常に安定で、実験室内、空気中で60日間経過後も95%以上のMIDAが残っています。ボロン酸は、クロスカップリング反応が起こるより速くin situで分解するため、鈴木カップリング反応の効率は、ボロン酸の保存の影響だけでなく、それぞれのボロン化合物の性質に左右されます。さらに複雑なことに、分解は、多くの鈴木カップリング反応の条件下や反応試薬の存在下で加速されます。この分析に矛盾することなく、調製したてのボロン酸をクロスカップリングに用いた場合でさえ、収率は一般に低いか中程度にとどまります。対照的に、ボロン酸MIDAエステルで同じ反応を行うと、クロスカップリング生成物が極めて高効率的に得られます(表 2)。
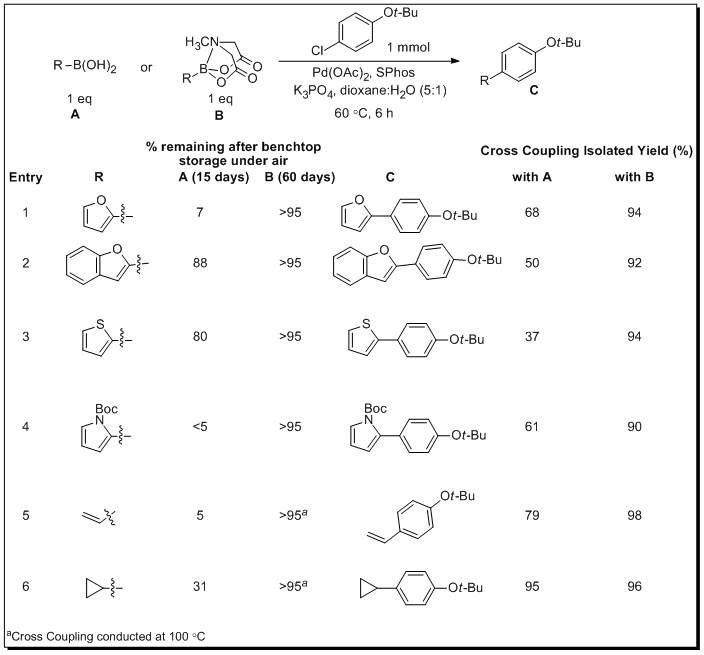
表 2.ボロン酸・ボロン酸MIDAエステルの実験室レベルでの安定性とカップリング効率の比較
この新たな性質について、これまで安定性に課題のあったボロン酸を対応するMIDAエステルに変換して幅広く検討がなされました。表 3には、不活性な塩化アリールもしくはヘテロアリールクロリド(多くは電子的または立体障害により不活性)の鈴木-宮浦クロスカップリング反応で効果を示すボロン酸MIDAエステルを示しています。2-置換ヘテロアリールボロン酸MIDAエステルに加え、ビニルボロン酸MIDAエステルおよびシクロプロピルボロン酸MIDAエステルが、ボロン酸を緩やかにリリースする条件下で、不活性なヘテロアリールクロリドとの困難なカップリングに良い結果をもたらしました。無保護のボロン酸は、一般にはクロスカップリングの基質としては適さないと考えられていますが、緩やかなリリースの条件下でMIDAボロン酸エステルから生成する場合は実用的な合成基質となり、高収率でクロスカップリング生成物を与えます。
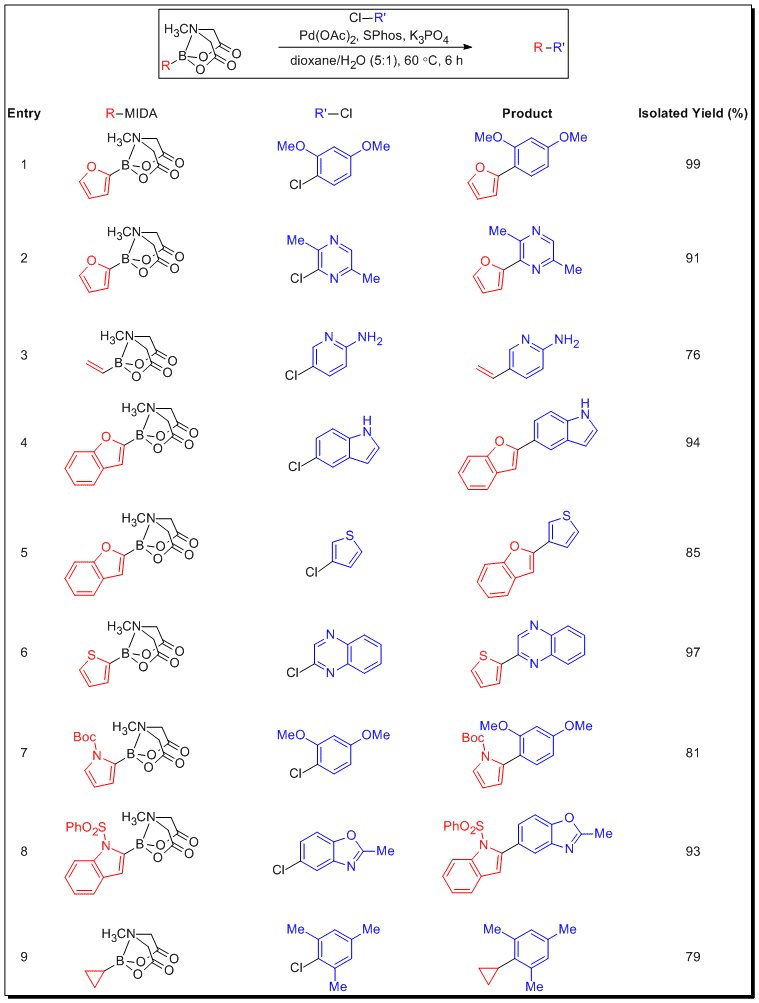
表 3.MIDAボロン酸エステルによる緩やかなクロスカップリング
非常に不安定な2-ピリジルボロン酸の代替となる空気中で安定な基質の開発は、この基質モチーフがドラッグライクな低分子物質の合成に有用であるため、クロスカップリングの分野で長年の課題でした。2-ピリジルボロン酸に代わる物質が存在する場合でも、空気や湿気に対する感受性や、いくらか変動する不純な組成により、その使用を困難にします。それに対し、2-ピリジルボロン酸MIDAエステルは単離可能で、実験室レベルでは空気中で安定であり、クロマトグラフィーによる精製が可能です。2-ピリジルボロン酸MIDAエステルの場合、上記で述べたボロン酸を緩やかにリリースするカップリング反応条件よりも、共溶媒として水の代わりにイソプロパノールを、かつ共触媒としてCu(OAc)2を用いることが有効でした。2-ピリジルボロン酸MIDAエステルは実験室レベルでは極めて安定で、X線による構造解析もなされています。2-ピリジルボロン酸MIDAエステルから活性なボロン種が緩やかにリリースされることにより、種々のアリールおよびヘテロアリールクロリドとのカップリングが進行します(表 4)。

表 4.2-ピリジルボロン酸MIDAエステルによる緩やかなクロスカップリング
Discover MIDA Boronates (1 Mb PDF)
ボロン酸MIDAエステルのリストをご覧ください。
詳細については、以下の資料をご覧ください。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?
