第III相・製造

第III相試験の治験バッチを製造する、もしくは商用化目的で薬剤を製造する場合、お客様のプロセスが常に高度な品質基準を満たしていることが求められます。この段階で検討すべき因子は、以下のとおりです。
- 確実な規制遵守
- 大規模生産のためにさらに最適化されたプロセスであるか、および最適化の方法を判定
- 製造を自社で行うか、CMOに外部委託するかを決定
最新のシングルユーステクノロジーが製造施設の柔軟性を向上します。シングルユーステクノロジーの活用によって技術移管にまつわる課題やリスクを最小限に抑える方法をご紹介します。技術移管とフィルターおよびシングルユース製品のバリデーションについてもご紹介します。
バイオテックリソース
- Make It Right: mRNAの製造に関する最良の実践法
このウェビナーで、mRNAの潜在能力やその製造ワークフローと施設の設計が再現性や性能にどのような影響を及ぼすのか確認します。
- コンセプト立案から臨床用材料に至るまでADCプログラムをサポートする統合アプローチ
ADCの製造の課題と可能性について探索し、原料の特性評価および統合的なアプローチによって、どのように製造が効率化されるのか探索します。
- 拡散:GCT製造のプロセスと施設の設計に関する検討事項
CGTに関するウイルスベクター治療用製品の製造特有の課題と戦略について学びます。施設の設計がどのように再現性と性能に影響を及ぼすのか学びます。
- ウイルスベクターを届ける高速道路のドライビング:AAV製造の加速化
テンプレート化されたウイルスベクター製造プロセスによって、どのようにAAV製造が加速化し、高スループットのスクリーニングで効率性が向上してトランスフェクションが改善されるのかについて学べます
- ガイドブック:とある分子の旅:成功への障害を打破
臨床開発の複雑さのかじ取りをするバイオ医薬品企業の幹部向けガイドブック。研究所から患者へと分子を無事に届ける方法を学びます。
製造施設の設計
製造施設の柔軟性を高めるには、スモールスケールから実生産まで対応できるシングルユースのバイオリアクタープラットフォームが役立ちます。臨床試験用ロットの製造から実生産まで、1つの製造施設でさまざまなバイオシミラーモノクローナル抗体の製造が可能な施設を設計、構築するには多くの課題があります。
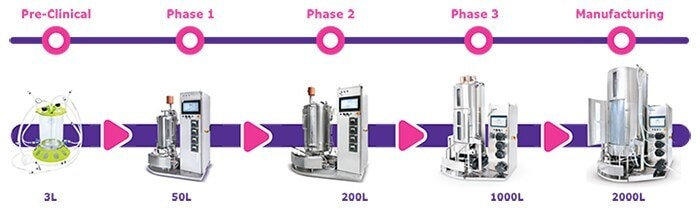
適切なリソースを利用すれば、必要とする患者様を救う画期的な新薬の発見に集中することができます。関心のある開発段階を選択してください。立ち上げ時にすぐに利用できるリソースについては、製品およびサービスのリンク先をご覧ください。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?





