第I相、第II相

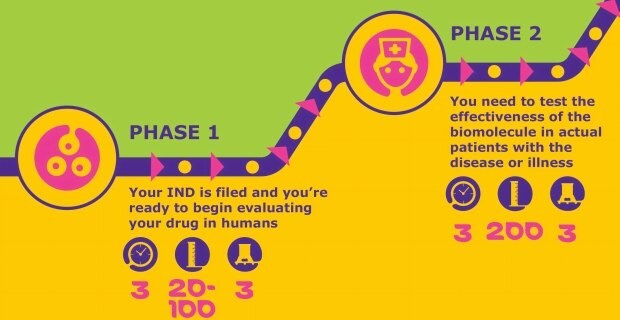
新薬治験開始申請(IND)が受領されたら、第I相試験を開始することができます。この開発段階では、健康な被験者を対象に薬剤候補物質の安全性が検討されます。
この段階で薬剤の製造能力の開発、標準化およびスケールアップを行い、適切な分析方法と品質管理プロセスに所定の標準化された能力があることを確認します。
薬剤候補物質の安全性が確立されたら、第II相試験で有効性を評価します。この段階の試験に成功することで、パートナーや投資家の関心を寄せることができます。この段階では、プロセスのスケールアップとさらなる最適化、ならびにエンドトキシン規格と無菌性の適合規を重点的に行います。
臨床試験スケールの製造プロセスの開発および実施は複雑で、多大な時間がかかることがあり、多くのコンポーネントの仕様の要求と調達、全てを統合してプロセスの立ちあげが必要となります。臨床スケールテンプレートによって、前臨床、第I相、第II相用の治験薬品の製造能力を迅速に立証できます。
テンプレート化されたプロセスについては、これらのバイオ医薬品アプリケーションガイドでご確認ください。
- ワクチン(mRNAなど)
- モノクローナル抗体(mAb)
- 抗体薬物複合体(ADC)
- 微生物
- プラスミドDNA(pDNA)
- 細胞・遺伝子治療(CGT)
バイオテックリソース
- バイオ医薬品アプリケーションガイド
mAb、ADCおよびmRNAプロセスに関するリソースやソリューションを提示する弊社のアプリケーションガイドでバイオ医薬品の状況のかじ取りをします。
- ある医薬品の開発:治験の成功への障害を打破
臨床開発の複雑さのかじ取りをするバイオ医薬品企業の幹部向けガイドブック。ラボからクリニックへと分子を無事に届ける方法を学びます。
- 品質および規制上のトレンド
高品質の製品を確保し、確実にコンプライアンスを重視したサービスやリスク管理を実施し、厳しい実施規定を遵守する方法を探索します。
- Using a 3L Disposable Bioreactor to Increase Your Throughput Development Capacity
このウェビナーでは、シングルユースバイオリアクターの効率性と無駄のなさについてお話します。3Lシングルユースバイオリアクターを使用すると、治療用タンパク質のプロセス開発において、開発能力のスループットがどの程度上昇するのか確認します。
- バイオシミラーのアップストリームプロセス開発:課題と有望さ
バイオシミラーのアップストリームプロセス開発の課題と有望さを探索します。プロセスの変更がどの程度製品の品質に影響を及ぼし、製造時の一貫性を達成できるか学びます。
- Mobius シングルユースバイオリアクターのスケーラビリティ: ベンチから臨床の規模まで
Mobius®シングルユースバイオリアクターがどのように開発能力のスループットを高め、ベンチから臨床の規模まで拡大縮小可能なソリューションを提供するかをご案内します。
適切なリソースを利用すれば、必要とする患者さんに有用である可能性が最も高い臨床的薬剤候補物質の発見に集中することができます。立ち上げ時にすぐに利用できるリソースについては、詳細を学ぶべき開発プロセスの段階を選定する、もしくは製品およびサービスのリンク先をご覧ください。
バイオテクノロジーハブリソースのワークフロー


創薬
新たな医薬品の開発に必要な検討事項、リソース、およびサポート

前臨床
新薬治験開始申請(IND)のための安全性および有効性の立証

第III相・製造
治験および商品化に向けたスケールアップおよび技術移管から高品質生産までの発展

スタートアッププログラム
お客様の医薬品の可能性を広げるリソースと承認プログラムの連結

規制
世界で最も厳格な規制を有する産業への挑戦は信頼されているガイドとともにはじまります。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?