おすすめの製品
グレード
Proteomics Grade
品質水準
形状
lyophilized powder
比活性
50-150 units/mg protein
分子量
29.5 kDa
組成
Protein, ~40% biuret
溶解性
H2O: soluble 0.9-1.1 mg/mL, clear, colorless
その他の活性
endopeptidase, essentially free
保管温度
−20°C
詳細
亜鉛を含有する酵素です。
特異性
N末端アミノ酸、特にロイシンの選択的な遊離を触媒しますが、グルタミン酸やアスパラギン酸には作用しません。
アプリケーション
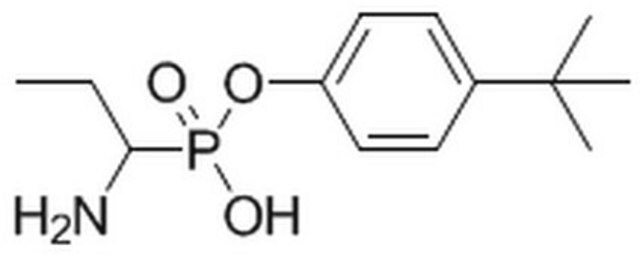
アミノペプチダーゼは広く分布しているプロテアーゼファミリーで、タンパク質の成熟、ホルモン産生およびペプチド消化など、多くの重要な生物学的過程の研究に使用できる可能性があります。この酵素は、一般的プロテアーゼ阻害剤であるベスタチンのアミノペプチダーゼへの結合動態における反応速度定数の測定に使用されています。
生物化学的/生理学的作用
エロモナス・プロテオリチカ由来のアミノペプチダーゼは、単一ポリペプチド内にZn2+原子が2つある分子量約29.5 kDa(沈降法で測定)の金属酵素です。この酵素は高度に安定しており、温度70℃でさえ数時間安定しています。8 M尿素中では部分的に不活化されます。最大の安定性および活性はpH 8.0~8.5で示されます。エロモナス・プロテオリチカ由来のアミノペプチダーゼはエステラーゼとしても機能できます。
エロモナス・プロテオリチカ由来のアミノペプチダーゼはタンパク質の成熟、ホルモン産生およびペプチド消化に関係しています。
単位の定義
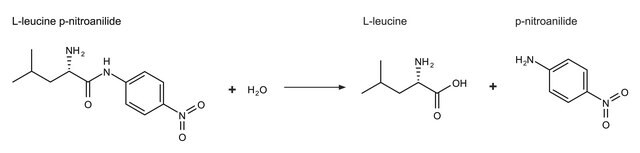
1ユニットは、pH 8.0、25°C、1分間で、1.0 μmolのL-ロイシンp-ニトロアニリドを加水分解してL-ロイシンとp-ニトロアニリンにする酵素量です。
物理的形状
凍結乾燥品(pH 8.0のトリシンバッファ-, 塩化亜鉛, 安定化剤を含有)。
調製ノート
0.9~1.1 mg/mL濃度で水に溶解すると、無色透明な溶液になります。
シグナルワード
Danger
危険有害性情報
危険有害性の分類
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
ターゲットの組織
Respiratory system
保管分類コード
11 - Combustible Solids
WGK
WGK 1
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
A8200-BULK:
A8200-100UN:
A8200-250UN:
A8200-VAR:
A8200-250UN-PW:
A8200-100UN-PW:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
この製品を見ている人はこちらもチェック
D Mahadevan et al.
Protein science : a publication of the Protein Society, 8(11), 2546-2549 (1999-12-14)
The Aeromonas proteolytica aminopeptidase (AMP), Pseudomonas sp. (RS-16) carboxypeptidase G2 (CPG2), and Streptomyces griseus aminopeptidase (SGAP) are zinc dependent proteolytic enzymes with cocatalytic zinc ion centers and a conserved aminopeptidase fold. A BLAST search with the sequence of the solved
S Nirasawa et al.
The Biochemical journal, 341 ( Pt 1), 25-31 (1999-06-23)
An aminopeptidase from Aeromonas caviae T-64 was translated as a preproprotein consisting of three domains; a signal peptide (19 amino acid residues), an N-terminal propeptide (101 residues) and a mature region (273 residues). We demonstrated that a proteinase, which was
Krzysztof P Bzymek et al.
The Journal of biological chemistry, 279(30), 31018-31025 (2004-05-13)
Glutamate 151 has been proposed to act as the general acid/base during the peptide hydrolysis reaction catalyzed by the co-catalytic metallohydrolase from Aeromonas proteolytica (AAP). However, to date, no direct evidence has been reported for the role of Glu-151 during
C Schalk et al.
Archives of biochemistry and biophysics, 294(1), 91-97 (1992-04-01)
The heat-stable aminopeptidase from Aeromonas proteolytica has been purified using two new procedures, with the aim of preparing large single crystals for X-ray analysis. In a first procedure, we tried to avoid any drastic conditions capable of inducing microheterogeneities in
William T Desmarais et al.
Structure (London, England : 1993), 10(8), 1063-1072 (2002-08-15)
The aminopeptidase from Aeromonas proteolytica (AAP) is a bridged bimetallic enzyme that removes the N-terminal amino acid from a peptide chain. To fully understand the metal roles in the reaction pathway of AAP we have solved the 1.20 A resolution
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)