おすすめの製品
リコンビナント
expressed in HEK 293 cells
詳細
The specific activity of ST6Gal I is measured by its ability to transfer sialic acid from CMP-NANA to asialofetuin.
アッセイ
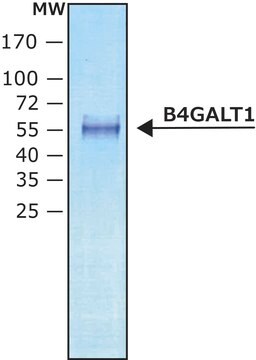
≥95% (SDS-PAGE)
形状
lyophilized powder
比活性
≥300 units/mg protein
輸送温度
ambient
保管温度
−20°C
詳細
生物化学的/生理学的作用
末端シアル化は、FcγRIIIaに対するシアル化抗体結合の減少により、Fcγ受容体結合の減少、抗炎症活性の増加、3 ならびに抗体依存性細胞傷害の増加をもたらすことが様々な研究で示されています。4-5
この組換えST6Gal I製品は、酵素の作用機序、ならびに阻害剤としての可能性を研究するために使用できます。in vitroで糖タンパク質を修飾するための糖鎖工学ツールとしても使用できます。
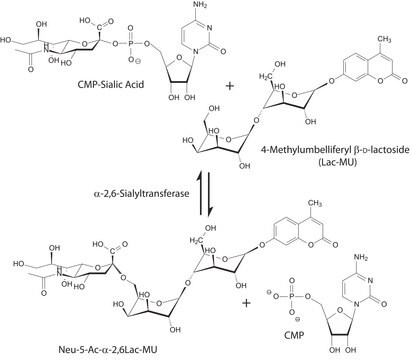
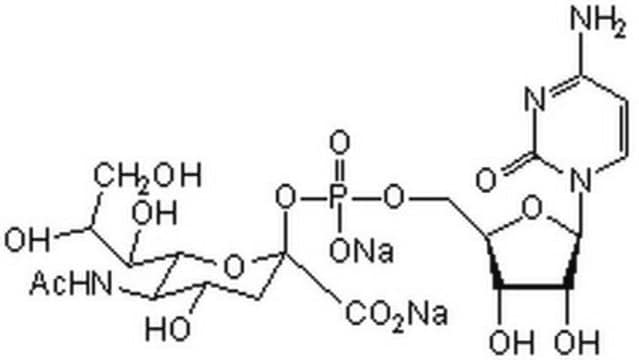
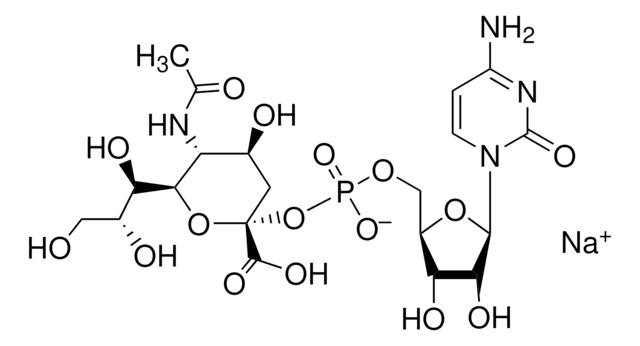
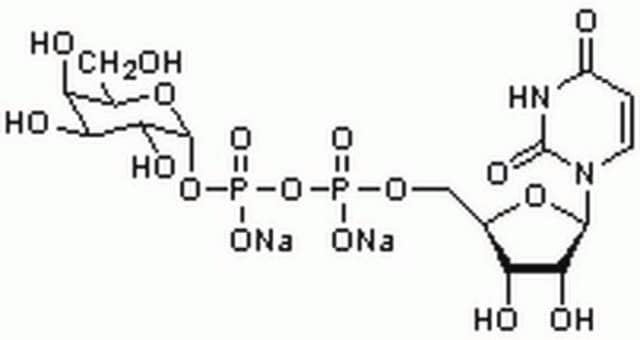
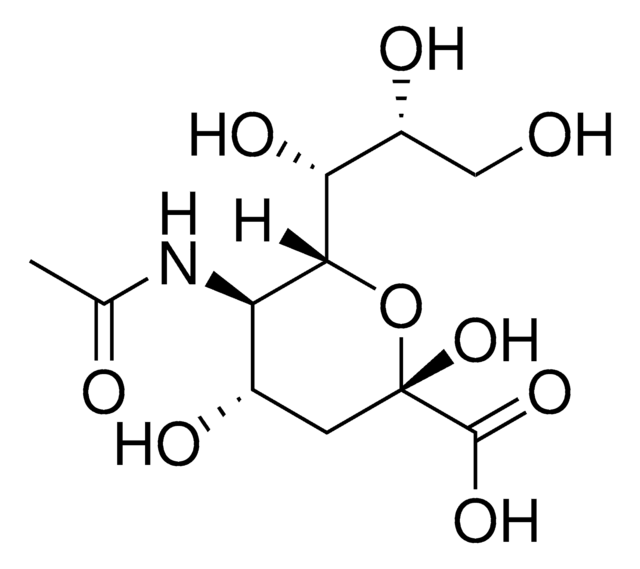
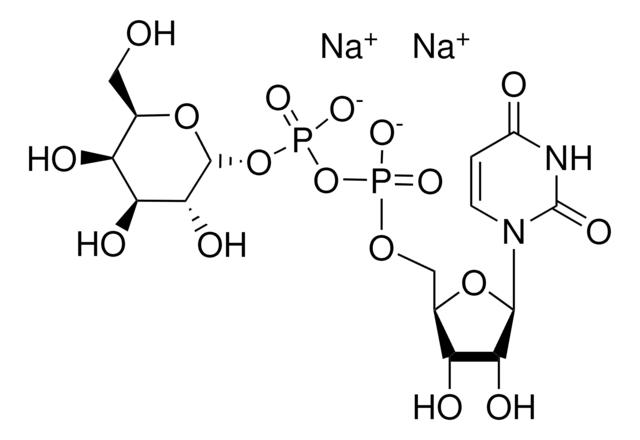
CMP-N-アセチルニューラミネート(CMP-シアル酸、CMP-NANA)から糖タンパク質のβ-D-ガラクトシル-1,4-N-アセチル-D-グルコサミニル末端へ。
シアル酸は、様々な糖脂質および糖タンパク質に分布しています。シアル酸はガラクトース(Gal)に添加されると、Galの炭素-3に結合しているヒドロキシルに結合してα-2,3グリコシド結合を形成するか、または炭素-6に結合しているヒドロキシル基に結合してα-2,6グリコシド結合を形成することができます。ST6Gal Iは、オリゴ糖および複合糖質の非還元末端Galβ1 4GlcNAc残基にシアル酸のα-2,6結合を形成します。
末端シアル化は、FcγRIIIaに対するシアル化抗体結合の減少により、Fcγ受容体結合の減少、抗炎症活性の増加、ならびに抗体依存性細胞傷害の増加をもたらすことが様々な研究で示されています。
単位の定義
保管分類コード
11 - Combustible Solids
WGK
WGK 2
引火点(°F)
Not applicable
引火点(℃)
Not applicable
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
SAE0090-10UG-PW:
SAE0090N-BULK:
SAE0090-10UG:
SAE0090-VAR:
SAE0090-BULK:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
資料
Explore tools for glycosyltransferase synthesis and modification of glycans, such as glycosyltransferases and nucleotide sugar donors.
Enzymatic glycosyltransferase specificity challenges the one enzyme-one linkage concept.
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)