G1549
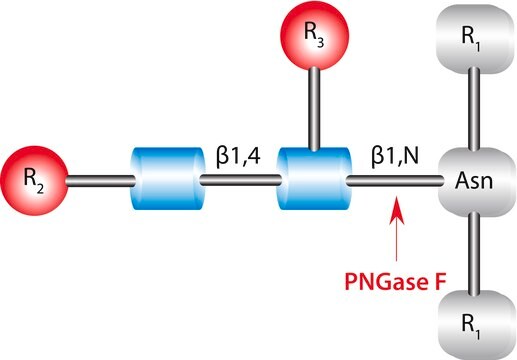
PNGase F Elizabethkingia meningoseptica由来
ready-to-use solution, recombinant, expressed in E. coli
別名:
N-グリコシダーゼF, PNGase F Chryseobacterium meningosepticum由来, PNGase F Flavobacterium meningosepticum由来, ペプチドN-グリコシダーゼ
About This Item
おすすめの製品
リコンビナント
expressed in E. coli
品質水準
結合体
(N-linked)
グレード
Proteomics Grade
形状
ready-to-use solution
比活性
≥1000 U/mg
シェルフライフ
≥1 yr at -20 °C
分子量
~36 kDa
輸送温度
wet ice
保管温度
−20°C
類似した製品をお探しですか? 訪問 製品比較ガイド
関連するカテゴリー
アプリケーション
生物化学的/生理学的作用
単位の定義
物理的形状
保管分類コード
10 - Combustible liquids
WGK
WGK 1
引火点(°F)
Not applicable
引火点(℃)
Not applicable
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
G1549-300UN-PW:
G1549PROC:
G1549-PH:
G1549-BULK:
G1549-50UN:
G1549-50UN-PW:
G1549-VAR:
G1549-300UN:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
この製品を見ている人はこちらもチェック
資料
Antibody fragmentation with our pepsin digestion protocol for IgG antibody fragmentation and preparation of F(ab’).
Explore strategies for releasing N-linked glycans with PNGase F, PNGase A & native & sequential deglycosylation with endoglycosidases & exoglycosidases.
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)