おすすめの製品
製品名
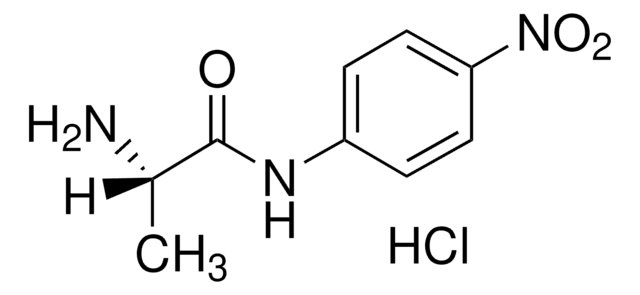
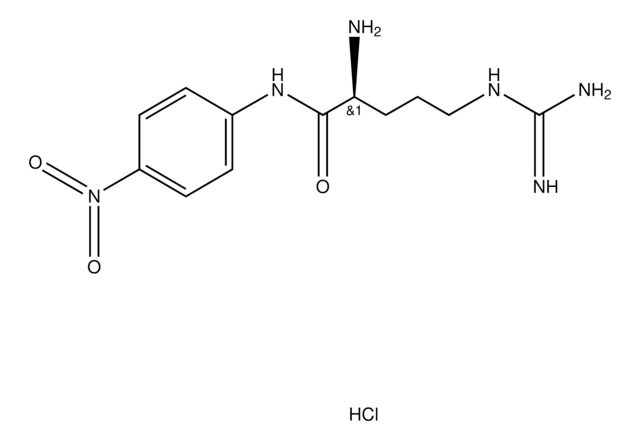
L-プロリン p-ニトロアニリド トリフルオロアセタート塩, prolyl aminopeptidase substrate
品質水準
アッセイ
≥99% (TLC)
フォーム
powder
テクニック
ligand binding assay: suitable
色
white to yellow
保管温度
2-8°C
SMILES記法
OC(=O)C(F)(F)F.[O-][N+](=O)c1ccc(NC(=O)[C@@H]2CCCN2)cc1
InChI
1S/C11H13N3O3.C2HF3O2/c15-11(10-2-1-7-12-10)13-8-3-5-9(6-4-8)14(16)17;3-2(4,5)1(6)7/h3-6,10,12H,1-2,7H2,(H,13,15);(H,6,7)/t10-;/m0./s1
InChI Key
KYRVEVYREUUAKH-PPHPATTJSA-N
関連するカテゴリー
詳細
プロリンp-ニトロアニリド(P-pNA)は、小さなペプチドのN末端からプロリンを遊離する酵素である、プロリルアミノペプチダーゼ(プロリンイミノペプチダーゼ)に対する比色分析のための基質です。
アプリケーション
L-プロリンp-ニトロアニリドトリフルオロ酢酸塩は、フィブリル化ペプチド触媒であるPC4のアミド分解活性を測定するためのモノペプチド基質としても使用されています。
プロリンp-ニトロアニリド(P-pNA)は、キャベツ葉由来のプロリルアミノペプチダーゼ(プロリンイミノペプチダーゼ)の基質として使用されています。
保管分類コード
11 - Combustible Solids
WGK
WGK 3
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
P5267-BULK:
P5267-250MG:
P5267-1G:
P5267-VAR:
P5267-2G:
最新バージョンのいずれかを選択してください:
試験成績書(COA)
Lot/Batch Number
この製品を見ている人はこちらもチェック
Margarita Marinova et al.
Protein and peptide letters, 16(2), 207-212 (2009-02-10)
Chick-pea (Cicer arietinum L.) cotyledons are unique source of aminopeptidase - 8-9 U/g cotyledons was observed using L-leucine-p-nitroanilide as substrate. The aminopeptidase was purified (65 kDa, pI 4.8 ) reaching a specific activity of 220 U/mg at pH 7.0-7.2 and
Hongyu Yang et al.
World journal of microbiology & biotechnology, 32(11), 176-176 (2016-09-16)
Prolyl aminopeptidases are specific exopeptidases that catalyze the hydrolysis of the N-terminus proline residue of peptides and proteins. In the present study, the prolyl aminopeptidase gene (pap) from Aspergillus oryzae JN-412 was optimized through the codon usage of Pichia pastoris.
Cathal S Mahon et al.
Microbiology (Reading, England), 155(Pt 11), 3673-3682 (2009-06-27)
Fungi are capable of degrading proteins in their environment by secreting peptidases. However, the link between extracellular digestion and intracellular proteolysis has scarcely been investigated. Mycelial lysates of the filamentous fungus Talaromyces emersonii were screened for intracellular peptidase production. Five
Margarita Marinova et al.
Zeitschrift fur Naturforschung. C, Journal of biosciences, 63(1-2), 105-112 (2008-04-05)
Aminopeptidase, preferring phenylalanine-p-nitroanilide as substrate, and proline iminopeptidase, highly-specific for proline-p-nitroanilide, were isolated from cabbage leaves (Brassica oleraceae var. capitata). As pH optima, 7.2-7.5 for aminopeptidase activity and 8.0-8.5 for proline iminopeptidase were determined. Both peptidases were strongly inhibited by
Yoke-Ming Wong et al.
Biomacromolecules, 17(10), 3375-3385 (2016-09-20)
Amyloid fibers are classified as a new generation of tunable bionanomaterials that exhibit new functions related to their distinctive characteristics, such as their universality, tunability, and stiffness. Here, we introduce the catalytic residues of serine protease into a peptide catalyst
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)