3D 바이오프린팅이란?
3D 바이오프린팅을 수행하면 조직과 비슷한 복잡성으로 해부학적 형태의 기질을 설계하여 정교하게 제어되는 3D 세포 모델 및 조직 구조체를 생성할 수 있습니다. 구조와 조성의 제어가 뛰어나기 때문에 3D 바이오프린팅은 화장품 검사, 약물 발견, 재생 의학, 기능성 장기 교체 응용분야 등 의학 연구에서 충족되지 않은 여러 중요한 요구 사항을 해결할 잠재력을 가지고 있습니다.1 유도만능줄기세포(iPS 세포) 또는 중간엽줄기세포 등 환자 유래 줄기세포를 사용하여 맞춤형 질병 모델을 만들 수 있습니다. 응용분야에 따라 다양한 재료, 방법, 세포를 사용하여 원하는 조직 구조체를 생성할 수 있습니다(그림 1). 3D 바이오프린팅, 프로토콜 및 관련 제품에 관한 전문가 후기 기사 등 더 자세한 내용은 당사의 3D 바이오프린팅 안내서를 참조하십시오.

그림 1.조직 및 장기의 3D 바이오프린팅 바이오잉크는 배양된 세포와 다양한 생체 적합성 재료를 조합하여 만듭니다. 그러면 약물 검사, 질병 모델링, 체외 장기 이식을 위해 바이오잉크를 기능성 조직 구조체로 3D 바이오프린팅할 수 있습니다.
바이오잉크란?
바이오잉크는 살아 있는 세포와 세포외 기질 환경을 모방하는 생체재료를 함유하고 있어 세포 부착, 증식, 프린팅 이후의 분화를 지원합니다. 바이오잉크는 전통적인 3D 프린팅 재료와는 달리 다음 조건을 충족해야 합니다.
- 생리적 온도를 초과하지 않는 프린팅 온도
- 부드러운 가교 결합 또는 겔화 조건
- 독성이 없고 프린팅 후 세포에 의해 조절될 수 있는 생체 활성 성분
토출 기반 프린팅용 바이오잉크: 세포 캡슐화 하이드로겔
3D 바이오프린팅에서 세포 캡슐화 하이드로겔은 다세포 바이오프린팅 구성 단위를 형성하여 살아 있는 조직 구조를 만드는 데 사용됩니다. 세포 캡슐화는 다른 방법 및 재료와 비교할 때 세포 부착 및 지지체 내의 세포 및 생체 분자의 공간적 분포를 정밀하게 제어할 수 있습니다.1 처방된 패턴으로 여러 세포 유형과 성장 인자를 조합하면 고도로 복잡한 조직 구조체의 생성이 가능합니다.3 세포 캡슐화에 사용되는 바이오프린팅 재료는 생체 적합성 외에도 높은 수분 함량과 다공성이 있어야 캡슐화된 세포가 영양소를 받고 폐기물을 제거할 수 있습니다.1 수팽윤(water-swollen), 다공성 네트워크, 하이드로겔은 세포 캡슐화, 조직 공학, 3D 바이오프린팅 응용분야에 이상적인 재료입니다. 3D 바이오프린팅용 하이드로겔은 조절 가능한 기질 강도를 갖추고 프린팅 후 네트워크 리모델링이 가능해야 세포가 확산, 이동, 증식, 상호작용할 수 있습니다.9 바이오잉크에 다양한 재료가 사용되지만 가장 인기 있는 재료로는 젤라틴 메타크릴로일(GelMA), 콜라겐, 폴리(에틸렌 글리콜)(PEG), Pluronic®, 알긴산염, 탈세포화된 세포외 기질(ECM) 등과 같은 기반 재료입니다(표 1).
주요 바이오잉크 재료: 젤라틴 메타크릴오일(GelMA)
젤라틴 메타크릴오일(GelMA)은 조직 공학 및 3D 프린팅을 위한 교차결합된 하이드로겔을 형성하는 데 사용할 수 있습니다. GelMA 기반 바이오잉크는 탁월한 세포적합성, 조절 가능한 기질 강성, 개선된 인쇄적성, UV 또는 가시 광선 노출 시의 신속한 교차결합(광개시제의 종류에 따라 달라짐)이 특징입니다11. GelMA는 내피 세포 형태 발생, 심장 근육 세포, 상피 조직, 주입 가능한 조직 구조체, 골 분화, 연골 재생에 사용되어 왔습니다. 젤라틴 메타크릴오일은 약물 발견 응용분야의 마이크로스피어 및 하이드로겔에서도 사용되어 왔습니다.
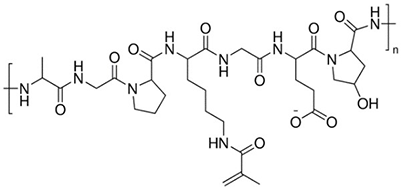
그림 2.젤라틴 메타크릴오일
무세포 재료: 구조적 지지체 및 고분자
3D 바이오프린팅된 구조에는 바이오잉크 외에 무세포 재료도 사용됩니다.2 무세포 재료는 일반적으로 조직 구조체에 대한 구조적 지지력을 제공하며, 바이오잉크와 함께 사용할 경우 바이오프린팅된 기능성 조직을 생성할 수 있습니다. 무세포 재료는 자연적 세포외 기질(ECM)의 기계적 특성과 생화학적 특성의 발달 단계를 반복하는 다공성 구조입니다4. 다공성을 통해 세포 이동, 조직 성장, 혈관 형성 및 이러한 구조적 구조체 내의 세포 생존이 가능합니다.6 또한 무세포 재료에는 세포 부착, 증식, 분화에 필요한 표면 화학도 있어야 합니다.5 인기 있는 무세포 재료에는 콜라겐, 피브린, 키토산, 나노셀룰로오스, 폴리(락트산)(PLA), 폴리카프로락톤(PCL), 히드록시아파타이트(HA), β-삼칼슘 인산염(β-TCP)이 있습니다(표 1).
바이오잉크 재료 구성 단위 | |||
|---|---|---|---|
| 바이오잉크 재료 | 개요 | 장점 | 단점 |
| 아가로스 | 해초에서 추출한 다당류 | 무독성 교차결합 높은 안정성 | 분해되지 않음 세포 부착 불량 |
| 알긴산염 | 갈조에서 자연 유래되는 생물 중합체 | 부드러운 교차결합 조건(Ca2+) 빠른 겔화 높은 생체 적합성 | 느린 분해 역학 세포 부착 불량 |
| 키토산 | 갑각류(예: 새우) 외골격에서 얻는 다당류. 비-동물 유래 키토산은 균류 발효에서 얻을 수 있음. | 높은 생체 적합성 항균 특성 | 느린 겔화 속도 |
| 콜라겐 | 피부 및 기타 결합 조직에서 발견되는 1차 구조 단백질 | 높은 생물학적 적합성 | 산 가용성 |
| 탈세포화된 ECM | 억제 자연 세포로부터 격리된 조직의 세포외 기질 | 높은 생물학적 적합성 조직 특이 높은 세포 생존율 | 정의되지 않으며 일관성 없음 자연 ECM 조직 손실 낮은 안정성 |
| 피브린/피브리노겐 | 혈액 응고 중에 형성되는 불용성 단백질 | 높은 생물학적 적합성 빠른 겔화 | 제한적 인쇄 적성 |
| 젤라틴 | 콜라겐의 부분적 가수 분해에서 유래하는 단백질 물질 | 높은 생체 적합성 높은 수용성 열 가역성 겔화 | 나쁜 모양 충실도 제한적 경도 |
| 그래핀 | 원자 하나 두께의 그래파이트 판으로 볼 수 있는 탄소 기반 재료 | 유연성 전기 전도성 | 낮은 생물학적 적합성 |
| 히알루론산(HA) | 결합 조직, 상피 조직, 신경 조직 전체에 광범위하게 분포된 비황산화 글리코사미노글리칸. | 빠른 겔화 세포 증식 증진 | 나쁜 안정성 |
| 히드록시아파타이트 | 치아와 뼈에서 발견되는 자연 발생하는 무기물 형식의 칼슘 인회석 | 높은 강도와 경도 | 낮은 인쇄 적성 제한적 조직 특이성 |
| PCL/PLA/PLGA | 생분해 가능한 열가소성 중합체 및/또는 혼성 중합체 | 높은 강도와 경도 | 낮은 세포 부착 및 증식 |
| Pluronic® F127 | 폴리(에틸렌 옥사이드) 및 폴리(프로필렌 옥사이드) 블록 혼성 중합체 | 실온에서 프린팅 가능 전단 박화 재료 | 장기 세포 배양에 부적합 |
3D 바이오프린팅 방법별 장단점
선택한 잉크 유형(바이오잉크 또는 무세포 재료)과 최종 조직 구조체의 복잡성에 따라 다양한 3D 프린팅 방법이 가능합니다(그림 1). 일반적인 방법의 장단점은 아래 표(표 2)에서 확인할 수 있습니다.
| 프린팅 방법 | 장점 | 단점 | 세포 적합성 여부 |
|---|---|---|---|
| 토출 기반 |
|
| 예 |
| 잉크젯 기반 |
|
| 예 |
| 광경화성 수지 조형(SLA) |
|
| 예 |
| 레이저 기반 |
|
| 예 |
| Fused-Deposition Modeling(FDM) |
|
| 아니요 |
| 선택적 레이저 소결법(SLS) |
|
| 아니요 |
잉크 유형 외에도 프린팅된 구조체의 최종 응용분야에 따라서도 바이오프린팅 방법이 결정될 수 있습니다(표 3).
결론
3D 바이오프린팅은 정의된 3D 미세 환경에서 공간적으로 제어되는 세포 배치가 가능합니다. 바이오잉크는 세포와 다양한 생체 적합 재료를 조합하여 형성되며, 이후 특정 형태로 프린팅되어 조직과 유사한 3D 구조를 생성합니다. 머크는 재료 공학과 세포 생물학에 관한 전문지식을 집대성하여 3D 바이오프린팅 워크플로를 단순화하는 다양한 솔루션을 제공합니다.
참고문헌
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?