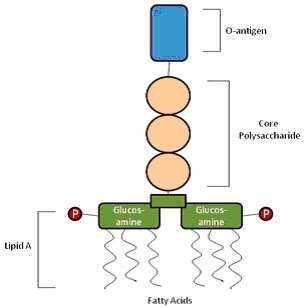
내독소와 외독소의 차이점은?
둘 다 잠재적으로 세포 배양에 위험성을 끼칠 수 있습니다. 외독소는 세균에 의해 분비되고 세포 밖에서 배출되는 보통의 단백질로 구성된 독성 물질입니다. 반면에 내독소는 세균의 세포벽 안에 있는 지질로 구성된 세균 독소입니다. 외독소는 보통 열에 의해 파괴되는 반면 내독소는 고온에서 박멸할 수 없습니다. 외독소는 항체 결합성이 높고 면역 반응을 이끌어내는 반면 내독소는 그렇지 않습니다.
내독소를 어떻게 테스트합니까?
LAL 분석(리물루스 아메보사이트 라이세이트)은 내독소에 대해 가장 일반적으로 사용하는 검사입니다. 투구게에서 유래한 LAL은 그램 음성균의 멤브레인 성분인 LPS(세균 내독소 지질다당류)와 반응해 정량화할 수 있는 겔 타입의 덩어리를 형성합니다. 내독소는 밀리리터당 내독소 단위(EU/mL)로 측정됩니다. EU 한 개는 약 0.1-0.2 ng의 내독소/mL의 용액과 동일합니다. 현재 LAL 분석에는 세 가지 형태가 있으며 각각 다른 민감도를 가지고 있습니다. LAL 겔 응고 분석에서는 0.03 EU/mL까지 검출할 수 있으며 LAL 운동성 탁도 측정 및 색소균 분석에서는 0.01 EU/mL까지 검출할 수 있습니다.
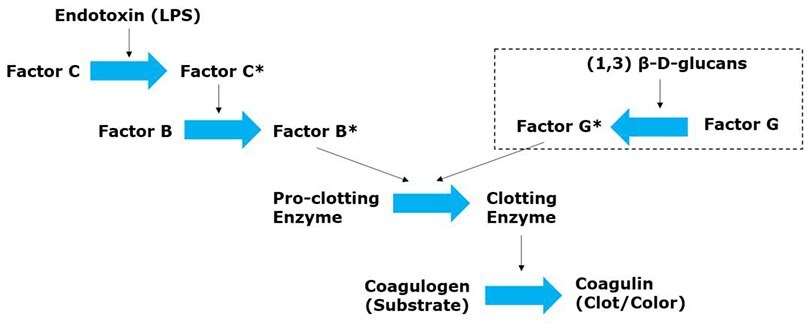
Figure 2.LAL assay test principle. The cascade of endotoxin detection in Limulus amoebocyte lysate (LAL) assay starts when the endotoxin LPS reacts with Factor C in and turn, activates the factor B. Factor B turns the gel-forming pro-enzyme into an enzyme. The resulting clotting enzyme is responsible for anchoring the two peptide units in the coagulogen, forming an insoluble gel. Other compounds which also cause the gelation in the amebocyte lysate of the horseshoe crab can interference in the test of bacterial endotoxins. Some of these compounds are (1,3)-β-D-glucans, which lead to false positives in the LAL test.
실험실에서 발견되는 내독소 오염의 가장 일반적인 원인은 무엇입니까?
세포 배양 실험실의 내독소 수치를 크게 낮추기 위해서는 모든 실험실 장비와 배지 원료의 철저한 청결과 올바른 실험법이 필수적입니다. 또한 세포에 주입하기 전에 모든 잠재적 내독소를 제거할 수 있는 여과 장치(예: Stericup® 필터 장치)를 사용하여 모든 배지를 여과하고 멸균하는 것이 좋습니다.
- 용수: 순도가 높은 물은 모든 실험의 필수 조건입니다. Milli-Q® Integral은 수돗물에서 바로 내독소를 제거한 초순수를 실험실에 공급하는 정제수 시스템입니다. 이 시스템에서는 하루 최대 300 L의 순수 및/또는 초순수를 생산할 수 있어 대부분의 실험실 요건을 만족시킵니다. 이외에도 당사는 모든 세포 배양 응용분야에 대해 일회용 내독소 제거수 병을 제공합니다.
- 혈청: 소태아혈정(FBS)은 생물학적으로 동물성 출처로 인하여 역사적으로 내독소를 포함한 주요 원인이었습니다. 그러나, 선별법 개선으로 위험이 상당수 감소했습니다. 모든 혈청은 높은 수준의 성능을 보장하기 위해 내독소 수치에 대한 테스트를 받습니다.
- 세포 배양 시약: Ecoli.에서 파생된 재조합형 성장 인자, 호르몬, 지질, 기본 배지, 트립신과 같은 분리 시약들은 모두 내독소의 원천이 될 수 있습니다. 머크의 모든 세포 배양 테스트 시약에 대해 내독소 수치를 검사합니다.
- 플라스틱/초자류: 초자류, 플라스틱 튜브 및 피팅은 파이로젠을 제거해야 하며, 재사용 시 주사용 증류수 또는 저농도의 내독소 용수로 헹구어야 합니다. 플라스틱 병은 감마선을 조사하여 살균해야 합니다.
- 사용자 오염: 세균은 피부, 머리카락 및 침의 모든 표면에 존재합니다. 따라서 세포 배양 과정에서 시스템에 내독소가 유입될 위험을 최소화하기 위해 적절한 무균 기술이 필수적입니다.
내독소가 세포 배양에 미치는 영향은 무엇입니까?
내독소는 체외 및 체내 세포 성장과 기능에 모두 영향을 미치며 상당한 가변성을 갖는 원천입니다. 체외에서, 내독소가 세포 배양 연구에 다양한 문제를 일으킨다는 증거가 늘어나고 있습니다. 기록에는 조직 인자를 생성하기 위한 백혈구 배양 자극, 대식세포에서 IL-6의 유도 생산, 매우 낮은 수준(1 ng/mL 미만)의 내독소에 의한 뮤린 군집 형성 억제 등의 영향이 있습니다. 체내에서, 내독소는 동물 연구의 염증 반응을 이끌어냅니다. 주사용 제품(백신 및 주사용 약물)에 내독소가 존재하게 되면 발열과 오한 등 가벼운 증상부터 돌이킬 수 없는 치명적인 패혈성 쇼크에 이르는 발열 반응을 일으킬 수 있습니다.
세포 배양에서 내독소의 허용 한계는 얼마나 됩니까?
미국 식품의약국(FDA)은 내독소 오염과 관련된 심각한 위험 때문에 실험실 연구원이 알아야 할 의료기기 및 비경구 약제에 대한 내독소 농도를 제한하고 있습니다. 현재 FDA에서는 의료 기기가 뇌척수액에 직접 접촉하지 않는 한 의료기기의 용출액이 0.5 EU/mL 미만이어야 하며, 한계는 0.06 EU/mL으로 제한하고 있습니다.
어떻게 하면 내독소 오염을 예방할 수 있습니까?
신뢰할 수 있는 시약 공급처에서 내독소 테스트를 거친 시약, 보충제 및 배지를 사용하는 것이 중요합니다. 또한 세포를 배양하기 전에 적절한 무균 기술을 사용하고 모든 세포 배양 플라스틱 용기와 피펫, 원뿔관 등의 소모품을 철저히 헹구어 살균하는 것도 중요합니다.
만약 배양액이 오염된다면 어떻게 내독소를 제거합니까?
배양액이 내독소로 오염되면 모든 시약과 세포를 폐기하고 새로운 시약과 세포로 시작할 것을 권장합니다. 그러나 시료를 폐기할 수 없는 경우 시약을 사용하여 내독소를 제거할 수 있습니다. 이러한 내독소 제거 솔루션은 Triton X-114의 미셀 속성(micellar properties)을 이용하여 시료에서 LPS 내독소를 제거합니다.
재료
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?