おすすめの製品
詳細
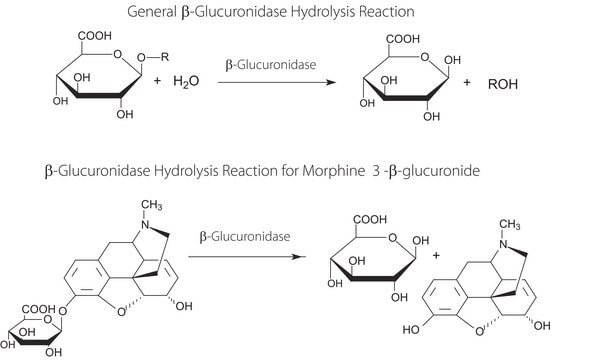
スルファターゼは、その活性部位に保存されているCys/Ser-X-Pro-X-Argモチーフからなります。
アプリケーション
Aerobacter aerogenes(アイロゲネス菌)由来のスルファターゼは、以下の用途に使用されています:
- 液体クロマトグラフィー/タンデム質量分析(LC/MS/MS)用いたケルセチン定量のための血漿検体処理のための脱共役酵素として
- 活性ベースのプローブプローブ1を用いた蛍光強度ベースの酵素アッセイで
- スルファチドリポソームの処理によるスルファチドからの3-O-sulfogalactosyde headの除去のため
生物化学的/生理学的作用
スルファターゼは硫酸エステル結合を加水分解して、無機硫酸を生成します。微生物スルファターゼは硫黄除去に関与し、硫黄の利用に不可欠な酵素です。病原性と関連する可能性があります。市販のAerobacter aerogenes(アイロゲネス菌)由来のスルファターゼは、抱合体からグルクロン酸および硫酸部分を除去する脱抱合酵素として有用です。スルファターゼは産業や農業での用途があります。
単位の定義
1ユニットは、pH 7.1、37°C、1分間に、1.0 μmolの硫酸p-ニトロフェニルを加水分解する酵素量です。
物理的形状
0.01 M Tris (pH 7.5)を含有する50%グリセロ-ルに溶解された溶液
保管分類コード
10 - Combustible liquids
WGK
WGK 2
引火点(°F)
Not applicable
引火点(℃)
Not applicable
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
S1629-50UN:
S1629-VAR:
S1629-10UN-PW:
S1629-50UN-PW:
S1629-10UN:
S1629-BULK:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
この製品を見ている人はこちらもチェック
Melanie Glauser et al.
Clinica chimica acta; international journal of clinical chemistry, 430, 125-128 (2014-01-15)
Total (i.e. free+sulfated) metanephrines in plasma is a biomarker for the diagnosis of pheochromocytoma/paraganglioma. Sulfated metanephrines must be completely deconjugated by perchloric acid hydrolysis or sulfatase treatment prior to analytical measurement to enable quantification by current techniques. In this report
T Saidha et al.
Archives of biochemistry and biophysics, 272(1), 237-244 (1989-07-01)
Mitochondria that have been purified from cells of light-grown wild-type Euglena gracilis Klebs var. bacillaris Cori or dark-grown mutant W10BSmL and incubated with 35SO4(2-) and ATP accumulate a labeled compound in the surrounding medium. This compound is also labeled when
Toshiyuki Nakamura et al.
Bioscience, biotechnology, and biochemistry, 75(8), 1506-1510 (2011-08-09)
β-Glucuronidase and sulfatase are the major deconjugating enzymes used in the cleavage of the glucuronate and sulfate moieties, respectively, from certain conjugated food factors including polyphenols. In the present study, we found that compounds having the same molecular weights as
C Gil et al.
Biochimica et biophysica acta. Biomembranes, 1861(1), 161-169 (2018-11-23)
Epsilon toxin (Etx) from Clostridium perfringens is synthesized as a very low-active prototoxin form (proEtx) that becomes active upon proteolytic activation and has the capacity to cross the blood-brain barrier (BBB), thereby producing severe neurological effects. The identity and requirements
Toyokazu Miura et al.
Bioscience, biotechnology, and biochemistry, 70(6), 1509-1512 (2006-06-24)
Arylsulfatase activity was detected in a bacterial strain, Citrobacter braakii 69-b, isolated from soil by enrichment cultivation using porcine gastric mucin. The production of arylsulfatase was derepressed markedly in a synthetic medium by the addition of tyramine. The purified enzyme
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)