由来生物
bovine pancreas
品質水準
タイプ
Type II
フォーム
essentially salt-free, lyophilized powder
比活性
≥40 units/mg solid
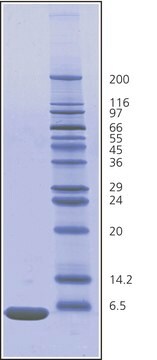
分子量
25,656 Da by calculation
精製方法
6× crystallization
溶解性
1 mM HCl: soluble 10 mg/mL, clear, colorless
UniProtアクセッション番号
その他の活性
α-chymotrypsin ≤1 U/mg (prior to activation by trypsin)
保管温度
−20°C
遺伝子情報
cow ... CTRB1(618826)
詳細
アプリケーション
生物化学的/生理学的作用
単位の定義
その他情報
保管分類コード
11 - Combustible Solids
WGK
WGK 3
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
C4879-VAR:
C4879-250MG:
C4879-1G:
C4879-BULK:
C4879-5G:
C4879-100MG:
最新バージョンのいずれかを選択してください:
試験成績書(COA)
この製品を見ている人はこちらもチェック
資料
Analytical Enzyme Chymotrypsin: Chymotrypsin is produced in the acinar cells of the pancreas as the inactive precursor, chymotrypsinogen.
Chromatograms
application for HPLCライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)