おすすめの製品
品質水準
アッセイ
≥98% (HPLC)
形状
powder
色
white to off-white
溶解性
DMSO: >20 mg/mL
保管温度
2-8°C
SMILES記法
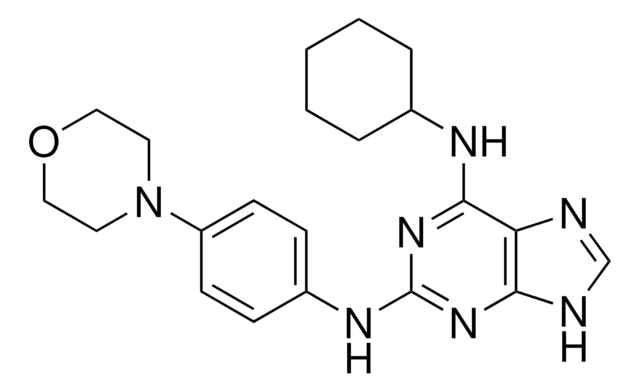
CC1=C(C(NC(=O)N1CCCCCC(O)=O)c2ccc(cc2)-c3ccccc3)C(=O)OCc4ccccc4
InChI
1S/C31H32N2O5/c1-22-28(30(36)38-21-23-11-5-2-6-12-23)29(32-31(37)33(22)20-10-4-9-15-27(34)35)26-18-16-25(17-19-26)24-13-7-3-8-14-24/h2-3,5-8,11-14,16-19,29H,4,9-10,15,20-21H2,1H3,(H,32,37)(H,34,35)
InChI Key
GHFQWLNXJMUCGC-UHFFFAOYSA-N
アプリケーション
116-9e has been used as an inhibitor of heat shock protein 70 (Hsp70) co-chaperone HDJ2 (human Ydj1/DNAJA1) to study the influence of HDJ2 on the regulation of ribonucleotide reductase (RNR) activity in HEK293 cells. It has also been used as an Hsp70 inhibitor to study the effect of Hsp70 chaperone on b5‐ops glycosylation in the side populations (SP) HeLa cells.
生物化学的/生理学的作用
116-9eは、Hsp40-Hsp70結合の遮断薬なので、Hsp70-Hsp40のシャペロン活性を阻害します。シャペロン補助因子のHsp40ファミリーは、保存されたJドメインを介してHsp70に結合します。116-9eは、Hsp70–Hsp40複合体の集合を妨げることによってシャペロン機能を阻害すると考えられています。
MAL2-11Bは、名称は異なるものの同じ化合物であり、大型の腫瘍抗原(TAg)であるウイルスのJドメインタンパク質の活性を阻害することがわかっています。MAL2-11Bは、TAgの内在性ATPアーゼ活性とTAgに仲介されるHsp70の活性の両方を阻害しました。
MAL2-11Bは、名称は異なるものの同じ化合物であり、大型の腫瘍抗原(TAg)であるウイルスのJドメインタンパク質の活性を阻害することがわかっています。MAL2-11Bは、TAgの内在性ATPアーゼ活性とTAgに仲介されるHsp70の活性の両方を阻害しました。
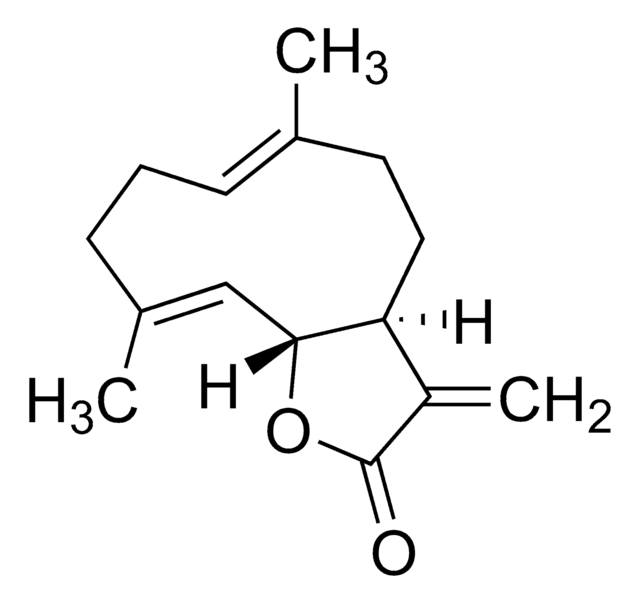
116-9e is a dihhydropyrimidine compound.
シグナルワード
Danger
危険有害性情報
危険有害性の分類
Acute Tox. 3 Oral - Aquatic Acute 1 - Aquatic Chronic 1
保管分類コード
6.1C - Combustible, acute toxic Cat.3 / toxic compounds or compounds which causing chronic effects
WGK
WGK 3
引火点(°F)
Not applicable
引火点(℃)
Not applicable
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
Isaac T Sluder et al.
PLoS genetics, 14(11), e1007462-e1007462 (2018-11-20)
Hsp70 is a well-conserved molecular chaperone involved in the folding, stabilization, and eventual degradation of many "client" proteins. Hsp70 is regulated by a suite of co-chaperone molecules that assist in Hsp70-client interaction and stimulate the intrinsic ATPase activity of Hsp70.
Bruna Figueiredo Costa et al.
Traffic (Copenhagen, Denmark), 19(3), 182-197 (2018-01-24)
Tail-anchored (TA) proteins insert into their target organelles by incompletely elucidated posttranslational pathways. Some TA proteins spontaneously insert into protein-free liposomes, yet target a specific organelle in vivo. Two spontaneously inserting cytochrome b5 forms, b5-ER and b5-RR, which differ only
Erina Matsuoka et al.
Functional plant biology : FPB (2019-06-21)
The heat shock protein 90 (HSP90) inhibitor, geldanamycin, is a chemical inducer of the heat shock response (HSR) in Arabidopsis. Geldanamycin is thought to activate the heat shock signal by dissociating the HSP90-heat shock factor (HSF) complex. Recent studies have
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)