おすすめの製品
由来生物
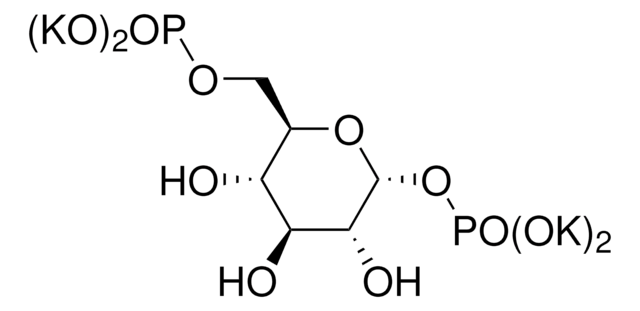
rabbit muscle
品質水準
詳細
ammonium sulfate suspension, >=100 units/mg protein
フォーム
ammonium sulfate suspension
比活性
≥100 units/mg protein
保管条件
(Tightly closed)
テクニック
activity assay: suitable
色
white to light yellow
その他の活性
lactic dehydrogenase ≤0.5%
phosphoglucose isomerase ≤0.01%
pyruvate kinase ≤0.05%
輸送温度
wet ice
保管温度
2-8°C
類似した製品をお探しですか? 訪問 製品比較ガイド
詳細
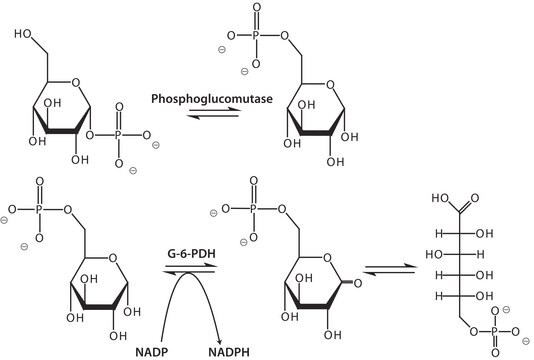
ホスホグルコムターゼ(PGM)は保存酵素であり、動物、植物、微生物に豊富に含まれています。ほぼすべての組織に分布しています。
アプリケーション
- ヒトにおける糖新生およびホスホグルコムターゼ欠乏の研究
- 代謝制御を調べるためのホスホグルコムターゼアッセイ
- 形質転換BL21(DE3)C43細胞におけるグリコーゲン代謝と密接に関連する酵素を調べるためのアッセイA
- スクロース合成酵素(SuSy)およびADPグルコースピロホスホリラーゼ(AGPase)のアッセイ(3)
- スクロースと無機リン酸(Pi)からグルコース-1-リン酸を定量するためにニコチンナミドアデニンジヌクレオチドリン酸(NADP+)の還元をカップリングするための酵素活性アッセイ
生物化学的/生理学的作用
単位の定義
物理的形状
アナリシスノート
抗体
保管分類コード
12 - Non Combustible Liquids
WGK
WGK 2
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, multi-purpose combination respirator cartridge (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
P3397-200UN:
P3397-2.5KU:
P3397-500UN:
P3397-VAR:
P3397-1KU:
P3397-BULK:
最新バージョンのいずれかを選択してください:
試験成績書(COA)
この製品を見ている人はこちらもチェック
資料
Instructions for working with enzymes supplied as ammonium sulfate suspensions
硫酸アンモニウム懸濁液として提供される酵素の使用方法
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)