ウイルスベクターワクチンの製造
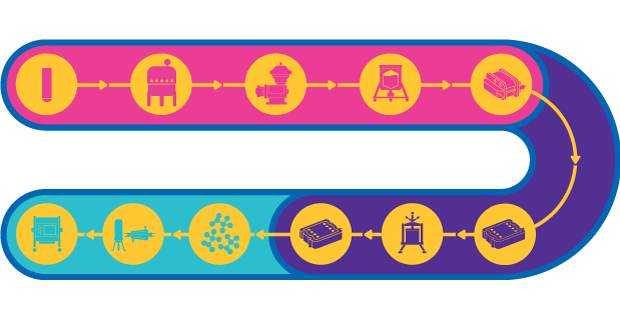
図1:ウイルスベクターワクチンに関する一連のプロセス
ウイルスベクターワクチンには、アデノウイルスなどの弱毒化、或いは無害な微生物を使用し、抗原の一部を体内に送り、免疫応答を刺激します。エイズやマラリア、がんなどの複雑な疾患では、免疫の誘発が極めて重要ですが、ベクターワクチンはこの免疫を強力に誘導することができます。
ワクチン用ベクターの製造工程は、かなりの部分がテンプレート化されています。しかし、さまざまな特性を持つ数種類のウイルスが治療では使用可能なため、課題が生じる場合があります。ウイルスベクターのサイズによっては、滅菌ろ過に伴う収率の低下が生じるため、工程の無菌性が非常に重要です。ベクターの凝集性と安定性にも課題があります。
さらに、第I相/II相の段階の工程の多くは、接着培養が含まれます。その結果、第III相と商業製造へのスケールアップの際に、目標の生産量を達成するために工程の調整が必要となる場合があります。最終製品において高力価の投与を達成できるように、開発後期になるほど製品の収率と純度が重要になります。
関連技術資料
- This technical article breaks down the adenovirus vaccine manufacturing process and provides a case study on developing an accelerated and cost-effective single-use adenoviral vector vaccine.
- Cost Modeling Vaccine Manufacturing: Estimate Production Costs for mRNA and other Vaccine ModalitiesA custom-designed cost model is used to explore the economics of vaccine manufacturing across several different modalities including mRNA. The model enables greater process understanding, simulates bottlenecks, and helps to optimize production efficiency.
- This page shows how to purify or remove viruses with a Capto DeVirS, AVB Sepharose High Performance from Cytiva.
- Method development for protein fingerprinting of AAV serotype 5 using both intact mass analysis and peptide mapping, to determine critical quality attributes for gene therapy, utilizing three different columns.
- Optimizing the upstream portion of gene therapy production sets the stage for successful manufacturing by maximizing viral vector titers. To increase upstream titers and process productivity, manufacturers must partner with upstream technology experts who work with HEK293, HEK293T and Sf9 cells. Draw on our experience today to speed your gene therapy to patients.
- すべて表示 (3)
確実にスケールアップしながら、臨床までの時間を短縮
ウイルスベクターワクチン製造用に開発されたアップストリームの培養工程は、生産性の要件が満たせるよう最適化されなければなりません。この最適化の作業には、細胞および細胞残屑の除去やベクターの確実な採取に不可欠な細胞溶解および清澄化のステップなどが含まれます。しかし、商用製造スケールへのスケールアップができない限り、アップストリームの工程がうまくいくことはありません。
不純物を確実に除去し、収率と効率の目標を達成します
溶解細胞由来の核酸は、ウイルスベクターワクチンのプロセスにおける一般的な不純物です。規制では、キャリーオーバーされる宿主細胞の核酸の濃度は、弱毒化ウイルスワクチン容量当たり10 ng未満とすることが求められています。Benzonase®エンドヌクレアーゼ阻害薬の使用後に行うタンジェンシャルフローフィルトレーションは、残った核酸成分を分解・除去する確実で強力な組み合わせです。
ダウンストリームの回収率を最大化する
小規模の臨床ロットは通常、CsClベースの密度勾配超遠心分離法を用いて精製されますが、大規模生産には2~3段階のクロマトグラフィー工程が必要です。陰イオン交換は通常、HCPやDNA、RNAなどの主要な汚染物質を除去するために用いられます。一方、サイズ排除クロマトグラフィーは、微量の汚染物質の除去に使用されます。
患者の安全を保証する
滅菌ろ過は、最終製剤の滅菌と患者の安全を保証します。微生物由来の汚染物質を除去するためには、フィルター孔径を0.22 µm以下にする必要があります。滅菌ろ過の工程で考慮すべき重要事項は、ウイルス凝集体の濃度です。これらの凝集体は、製剤過程の最適化により管理する必要があります。管理しなければ滅菌ろ過の工程において収率の大幅な低下という困難に直面する可能性があります。



ダウンストリーム - タンジェンシャルフローフィルトレーション

ダウンストリームのクロマトグラフィー
- Eshmuno® Q充填剤を用いたメンブレンクロマトグラフィー
- Natrix® Q Recon Miniクロマトグラフィーメンブレンを用いたメンブレンクロマトグラフィー
- Natrix® Q Pilotクロマトグラフィーメンブレンを用いたメンブレンクロマトグラフィー
- Natrix® Q Recon Miniを用いたメンブレンクロマトグラフィー
- Eshmuno Q充填剤を用いたメンブレンクロマトグラフィー
- Fractogel® EMD DEAEクロマトグラフィー充填剤を用いたキャプチャー/ポリッシングクロマトグラフィー
- Fractogel® EMD DMAEクロマトグラフィー充填剤を用いたキャプチャー/ポリッシングクロマトグラフィー
- クロマトグラフィー用Mobius® FlexReadyソリューション

ダウンストリームプロセス用薬品と製剤化

バイオプロセッシング液体細胞培養用培地・バッファー
メルクには、業界最高の品質を誇る滅菌ろ過済み製品の製造施設があり、お客様のバイオ医薬品製造を最適化するために世界中のGMP施設からすぐに使える細胞培養培地、バッファー、CIP製品、SIP製品をお届けしています。

最終無菌ろ過と充填
信頼性の高い確実な滅菌ろ過プロセスで、患者の安全を保証する
関連資料
- アプリケーションガイド:Biopharmaceutical
製造における課題の克服に役立つ検索ツール
- ミニハンドブック:Viral Vector Vaccine Bioprocessing
アデノウイルスベクターの製造プロセスは単純であり、高度にテンプレート化されています。このハンドブックでは概要をご説明します。
- ホワイトペーパー:Developing an Accelerated and More Cost-Effective Single-Use Adenoviral Vector Vaccine Manufacturing Process
Jenner Instituteとメルクとのコラボレーションにより、アデノウイルスベースのワクチンの製造のためのシングルユースでスケーラブルなGMPテンプレートが生まれました。さらに迅速でコスト効率の高いワクチン製造アプローチの詳細をご覧ください。
- アプリケーションノート:Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
このアプリケーションノートでは、ポリオウイルス3型生産プロセスでBenzonase® エンドヌクレアーゼを使用する利点をまとめています。
- 技術資料:Robust Harvest Clarification For Adeno-Associated Viral Vectors Via Depth Filtration
デプスフィルターによりAAVベクターを清澄化することで、遺伝子治療で重要なこれらのベクターに特有の分離に伴う課題を克服する役に立つことを実証します。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?





